概要
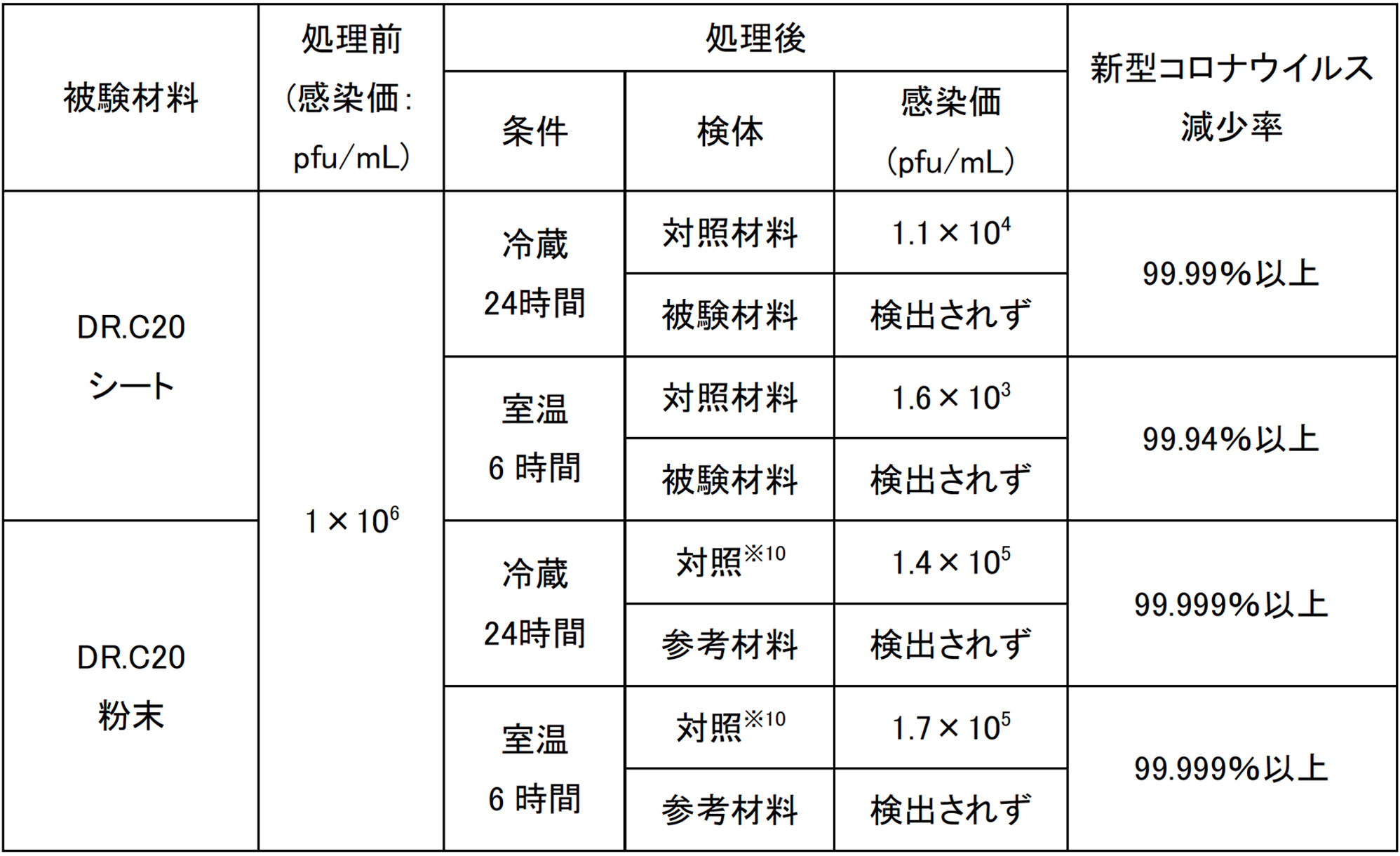
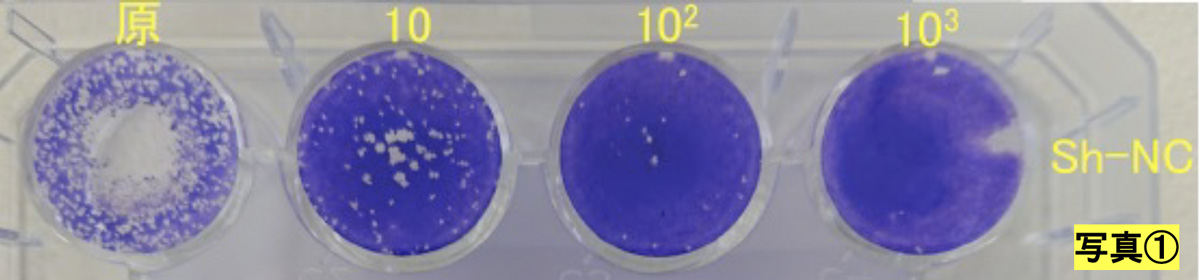
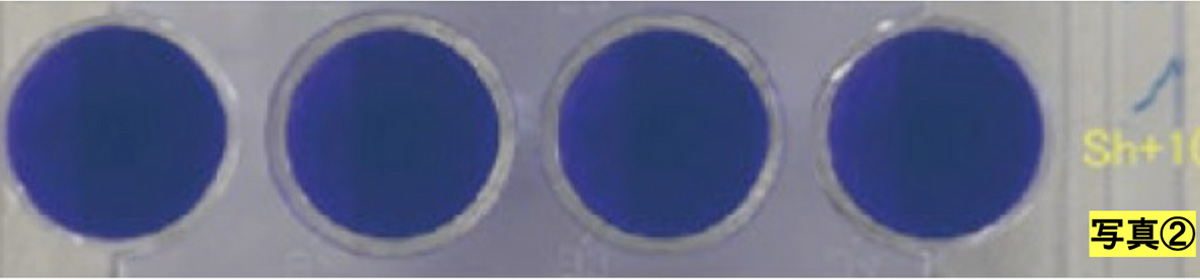
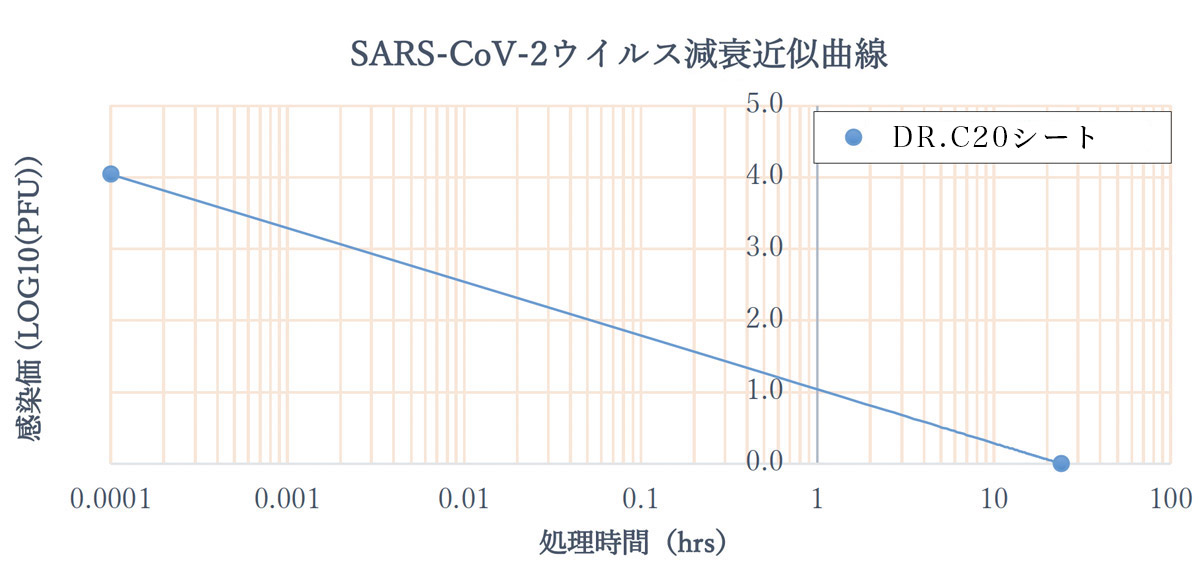
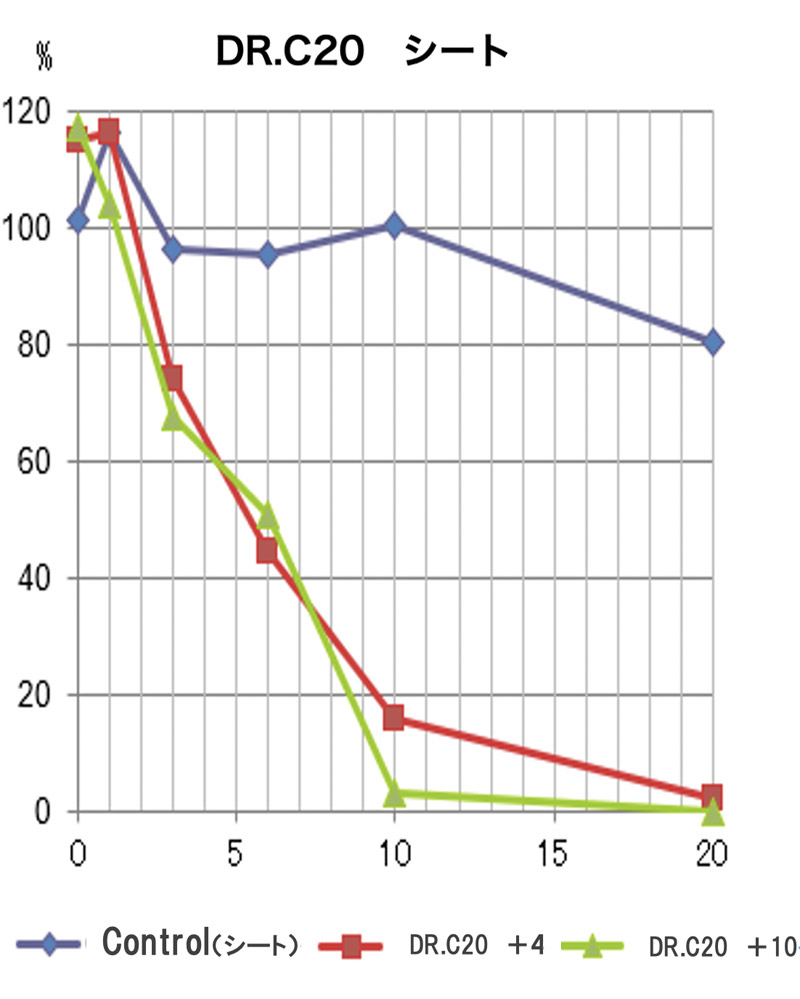
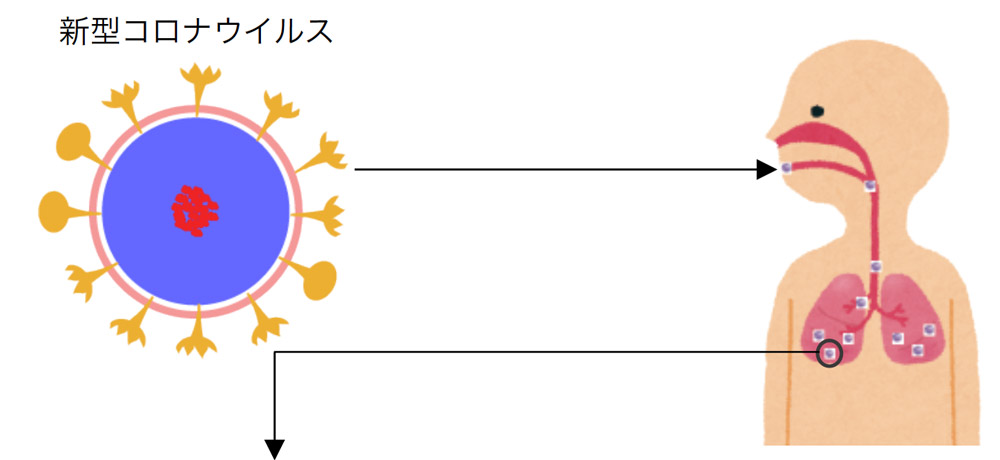
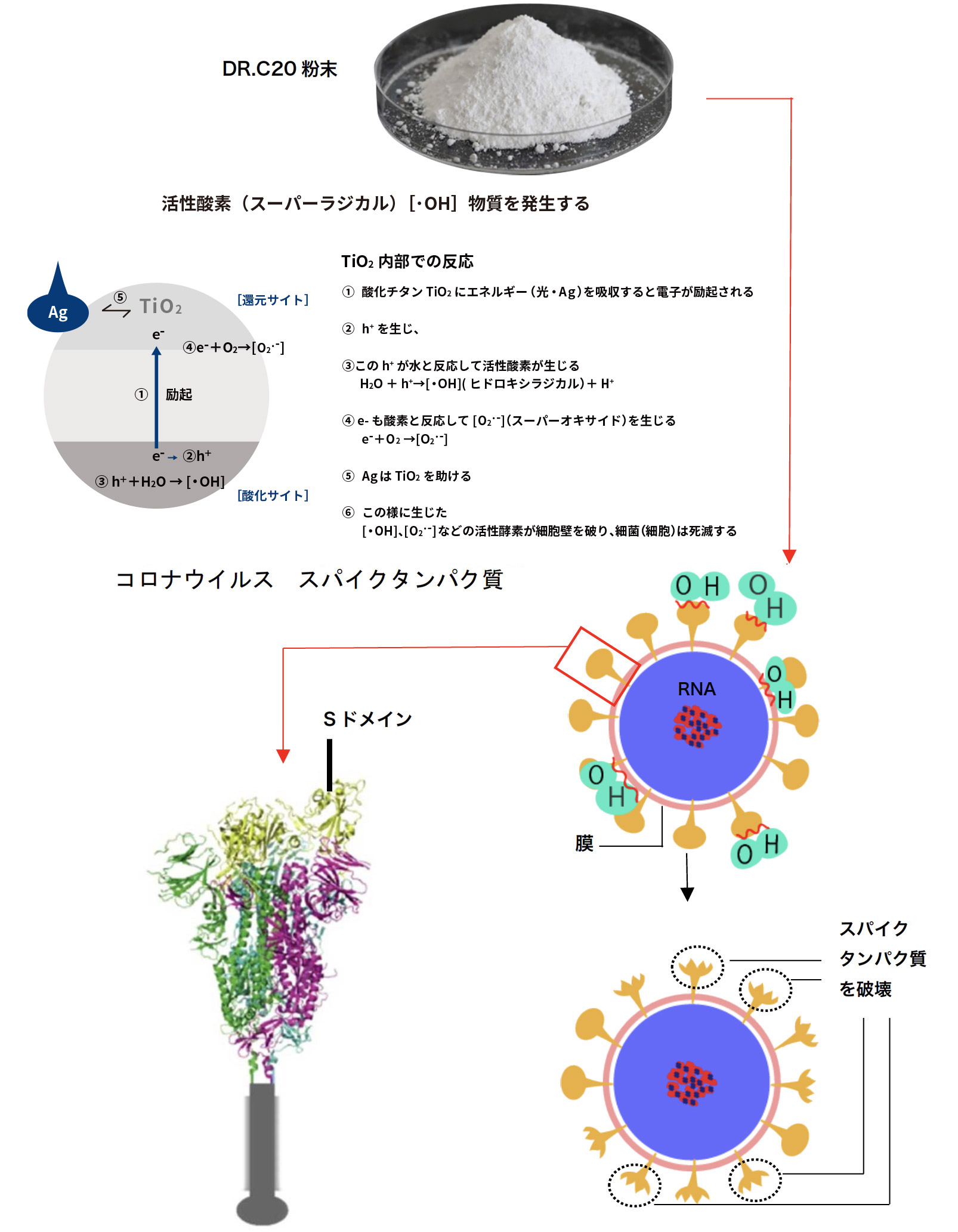
DRC医薬(株)(代表取締役 岡崎成実)は、感染症研究の世界的研究施設である長崎大学感染症共同研究拠点 安田二朗教授(兼 熱帯医学研究所新興感染症学分野教授)と共同で、新型コロナウイルス(SARS-CoV-2)溶液にDR.C20粉末を固着したシート(以下、DR.C20シート)を浸漬することにより、新型コロナウイルスの感染価が99.99%減少することを確認し、5分以内に99%以上減少することが推定されました。
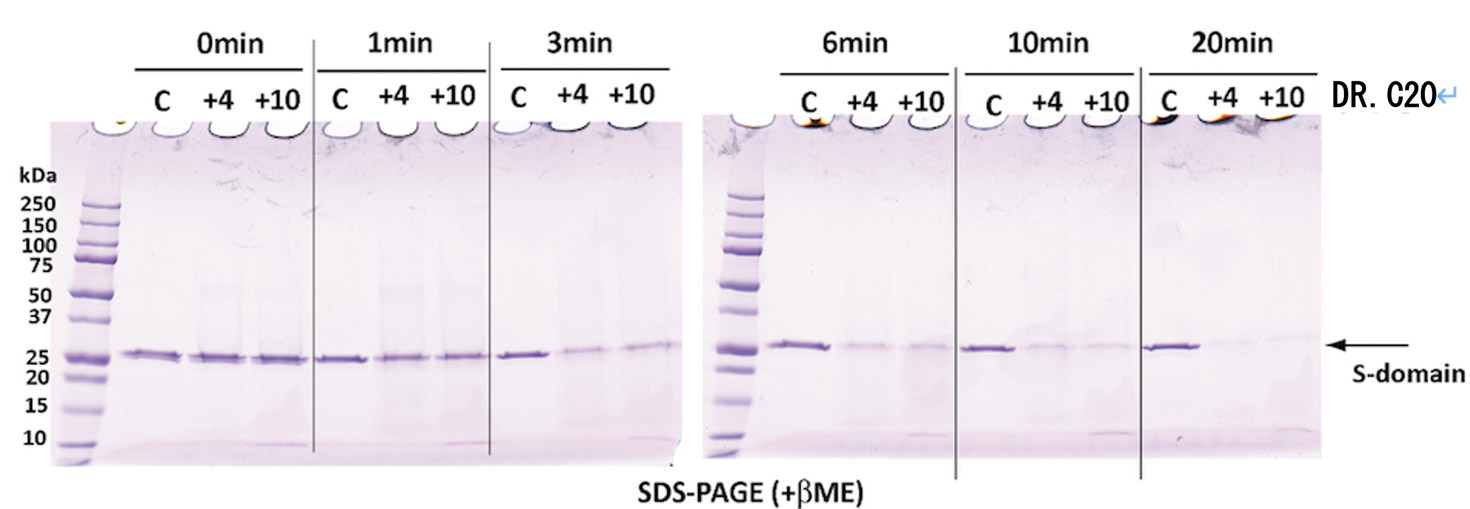
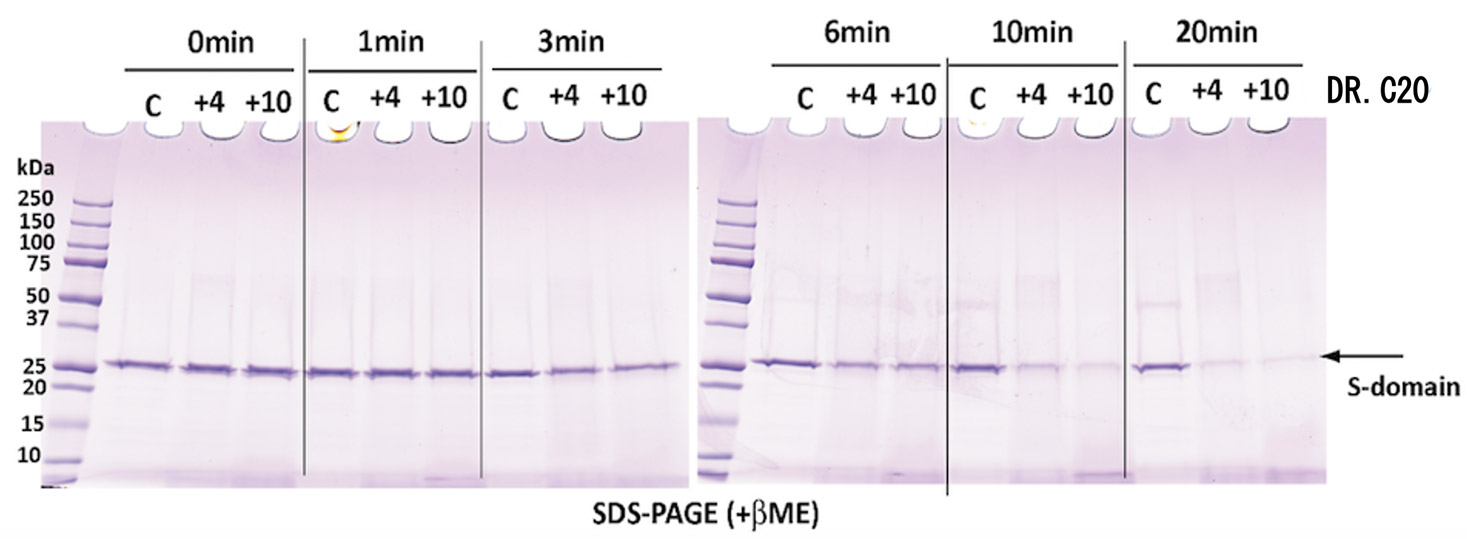
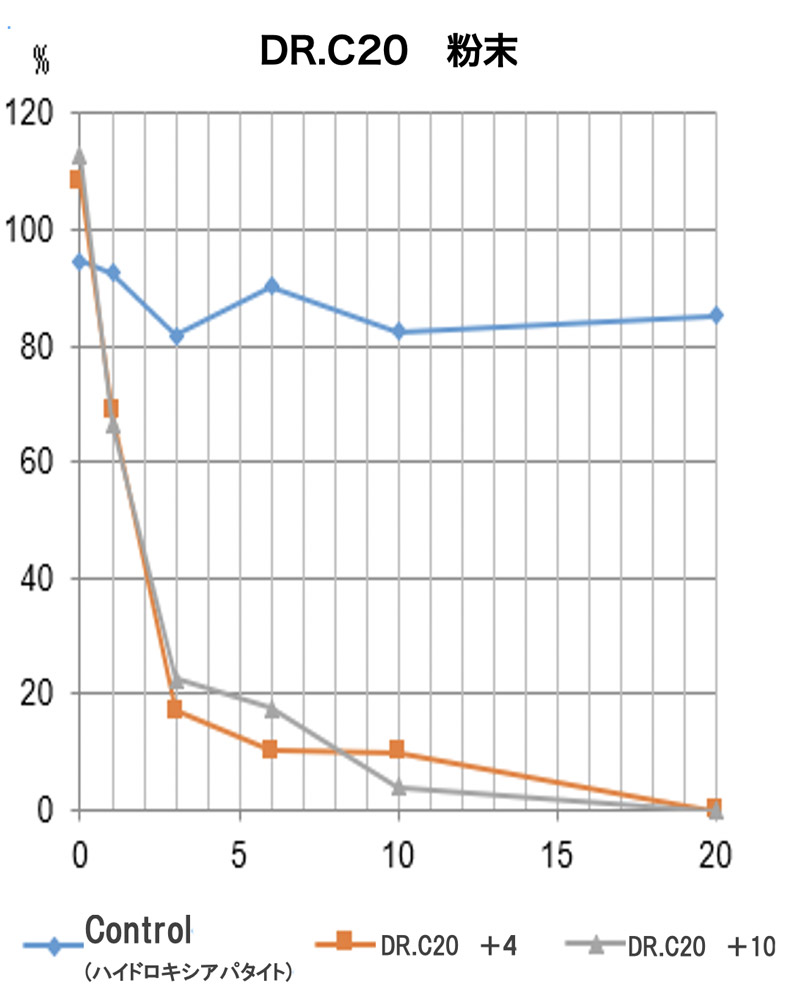
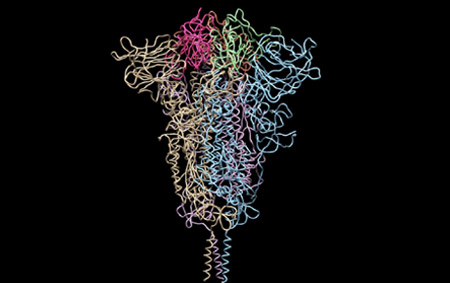
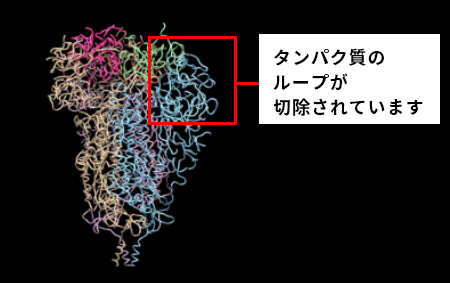
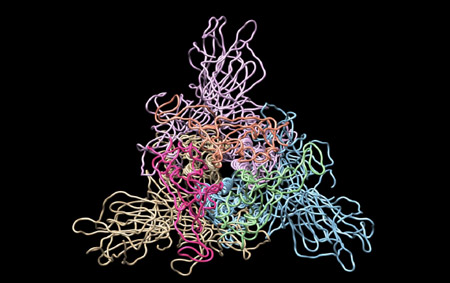
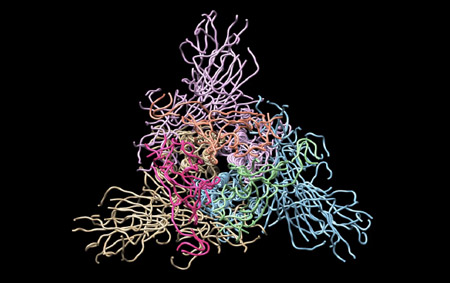
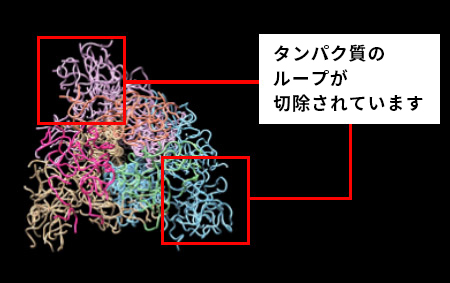
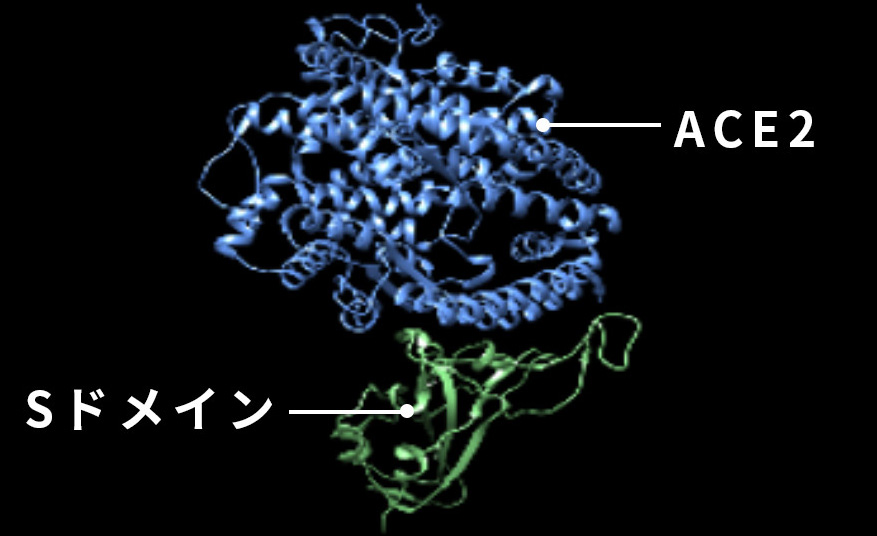
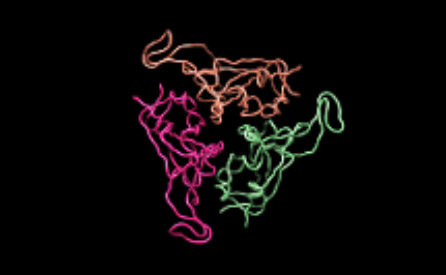
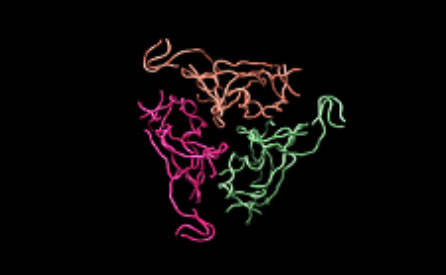
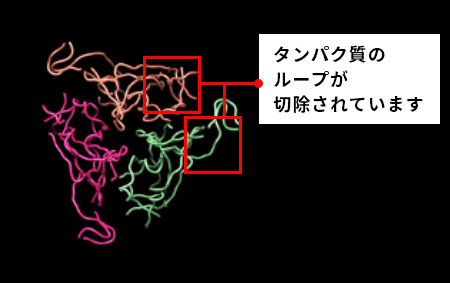
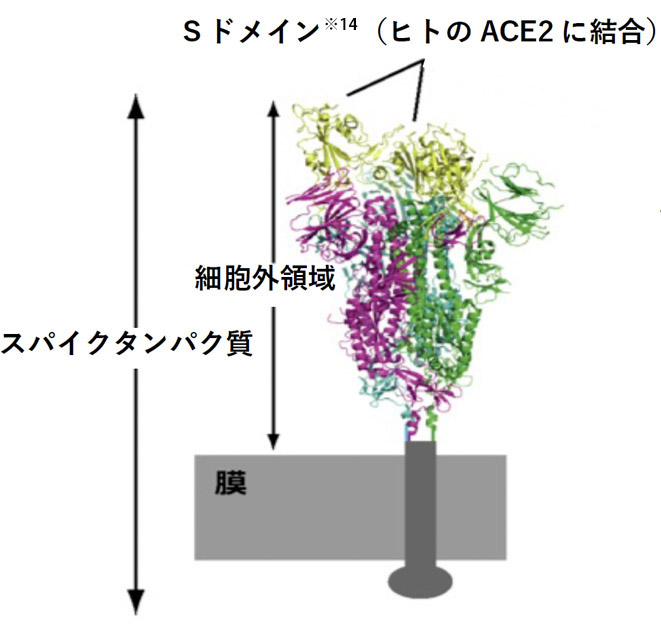
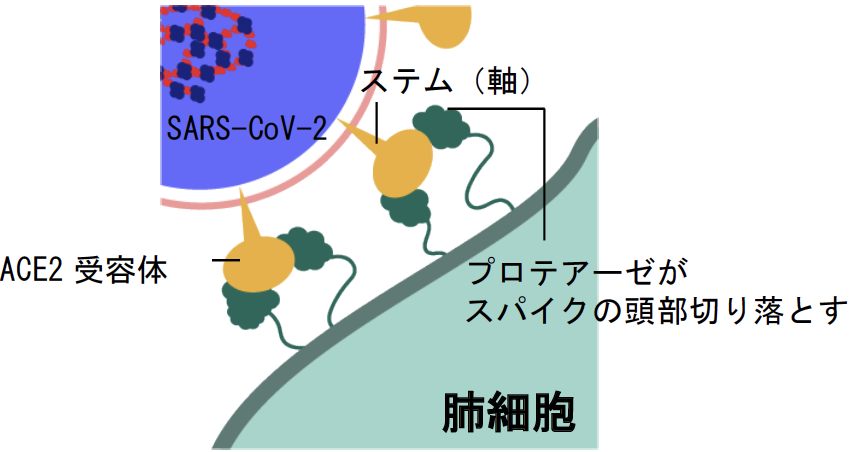
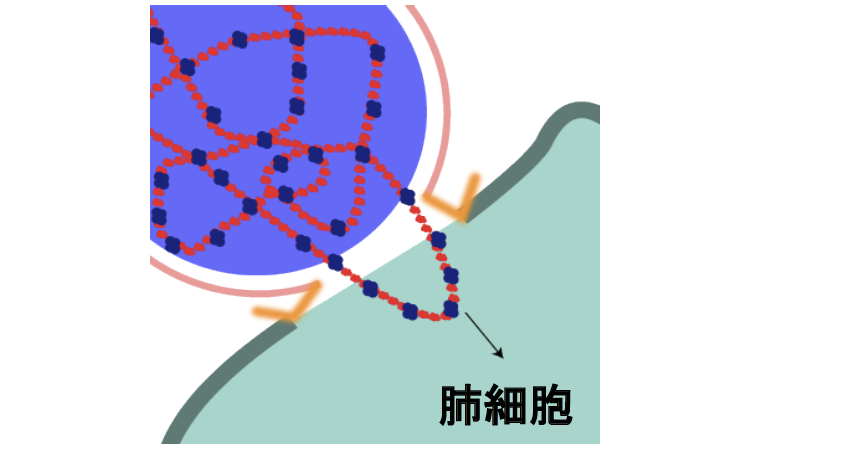
さらに、タンパク質合成で国際的に実績のある理化学研究所横山特別研究室 横山茂之特別招聘研究員と共同で、DR.C20が、新型コロナウイルスの感染に関わるスパイクタンパク質を人工的に合成したものを用いて実験した結果、3~10分の間に複数箇所で切断することを実証しました。東京大学大学院農学生命科学研究科 寺田透准教授の支援によって分子動力学シミュレーションを行った結果、DR.C20によるこのような切断により、スパイクタンパク質のヒト細胞受容体であるACE2 への結合に必要な立体構造が崩壊すると考えられました。これらのスパイクタンパク質へのDR.C20の効果は、ウイルスの感染価のDR.C20による減少と対応することが判明しました。